Indikationer
Lindring af symptomer, såsom hyppige opkastninger, gastrisk dilatation, kronisk gastritis, duodenal-gastrisk refluks og diarré, forbundet med nedsat gastrointestinal motilitet.
Dosering
Til oral anvendelse. Den anbefalede dosis er 0,22 mg metoclopramid (svarende til 0,25 mg metoclopramidhydrochlorid) pr. kg legemsvægt, 4 gange dagligt.
Den følgende tabel er beregnet som en vejledning til ordination/dosering af veterinærlægemidlet:
| Body weight kg | Dose mg/animal* | Vomend vet 5 mg | Vomend vet 10 mg | |
|---|---|---|---|---|
| 5-7.5 | 1.25 | |||
| >7.5-12.5 | 2.5 | OR | ||
| >12.5-17.5 | 3.75 | |||
| >17.5 -22.5 | 5 | OR |
| >22.5-27.5 | 6.25 | |||
|---|---|---|---|---|
| >27.5-32.5 | 7.5 | OR | ||
| >32.5-37.5 | 8.75 | |||
| >37.5-45 | 10 | OR | ||
| >45-55 | 12.5 | OR | ||
| >55-65 | 15 | OR | ||
| >65-75 | 17.5 | OR | ||
| >75-85 | 20 | OR |
= ¼ Tablet = ½ Tablet = ¾ Tablet = 1 Tablet
- dosis i mg metoclopramidhydrochlorid pr. dyr pr. dosering.
Tabletterne kan deles i 2 eller 4 lige store dele for at sikre en akkurat dosering. Placer tabletten på en flad overflade med delekærven opad, og den konvekse (afrundede) side mod overfladen.
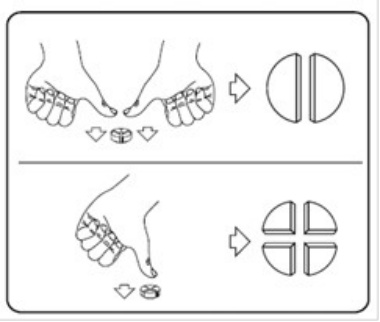
2 lige store dele: tryk ned med tommelfingrene på begge sider af tabletten. 4 lige store dele: tryk ned med tommelfingrene i midten af tabletten.
Tilbageholdelsestid
Ikke relevant.
Bivirkinger
Hunde:
| Meget sjælden (< 1 dyr ud af 10.000 behandlede dyr, herunder enkeltstående indberetninger): | Døsighed Diarré Neurologiske virkninger a (ophidselse, ataksi, unormale stillinger og/eller bevægelser, prostration, tremor og aggression, vokalisering) |
|---|---|
aDe observerede virkninger er forbigående, og forsvinder når behandlingen stoppes.
Indberetning af bivirkninger er vigtigt, da det muliggør løbende sikkerhedsovervågning af et veterinærlægemiddel. Indberetningerne sendes, helst via en dyrlæge, til enten indehaveren af markedsføringstilladelsen eller dennes lokale repræsentant eller til den nationale kompetente myndighed via det nationale indberetningssystem. Se indlægssedlen for de relevante kontaktoplysninger.


